lncRNA LINC00673-v4通過激活WNT/β-catenin信號傳導促進肺腺癌的侵襲性
肺癌是最常見的癌癥類型,非小細胞肺癌占肺癌的比例約為85%,肺腺癌(LAD)占非小細胞肺癌50%左右。轉移可在LAD早期階段發生,但驅動這種快速轉移能力的分子機制仍未完全了解。最近來自廣東中山大學的團隊在期刊PNAS上發表了一篇題名為:Long noncoding RNA LINC00673-v4 promotes aggressiveness of lung adenocarcinoma via activating WNT/β-catenin signaling的文章。該文章主要講述了lncRNA LINC00673-v4表達在LAD中上調并且與腫瘤侵襲進展的關系。

一、LINC00673-v4表達在LAD中上調并與淋巴結轉移和預后不良相關
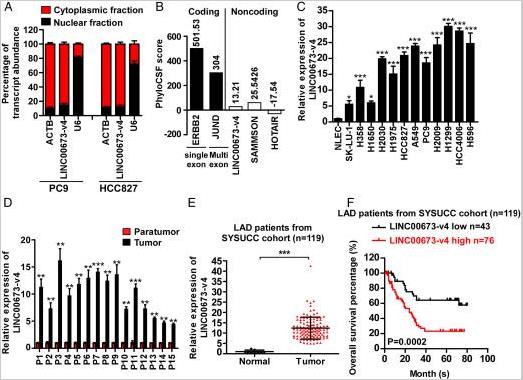
通過他人在TCGA轉錄組測序數據的整合分析,確定了關于WNT /β-連環蛋白信號傳導10種最高表達的lncRNA。使用熒光素酶測定法,評估了10種高表達的lncRNA轉錄物在LAD中的作用。沉默ENST00000457958.6導致LAD細胞中TCF / LEF活性的顯著抑制,而ENST00000457958.6與LINC00673-v4(NCBA)序列100%相同。使用FISH和細胞分離分析,在LAD細胞的細胞質中發現了LINC00673-v4大量存在。分析編碼潛力表示LINC00673-V4可能顯著缺乏蛋白質編碼能力。與原發性正常肺上皮細胞相比,LAD細胞系中LINC00673-v4的表達升高。通過qRT-PCR驗證分析LAD和癌旁組織中的LINC00673-v4水平,發現LAD LINC00673-v4表達顯著高于癌旁組織。大組織樣本量qRT-PCR驗證LAD和正常肺組織中的LINC00673-v4表達,結果同上。生存曲線分析顯示LINC00673-v4低表達較高表達生存率有顯著提升。
二、LINC00673-v4促進LAD細胞入侵,遷移和轉移
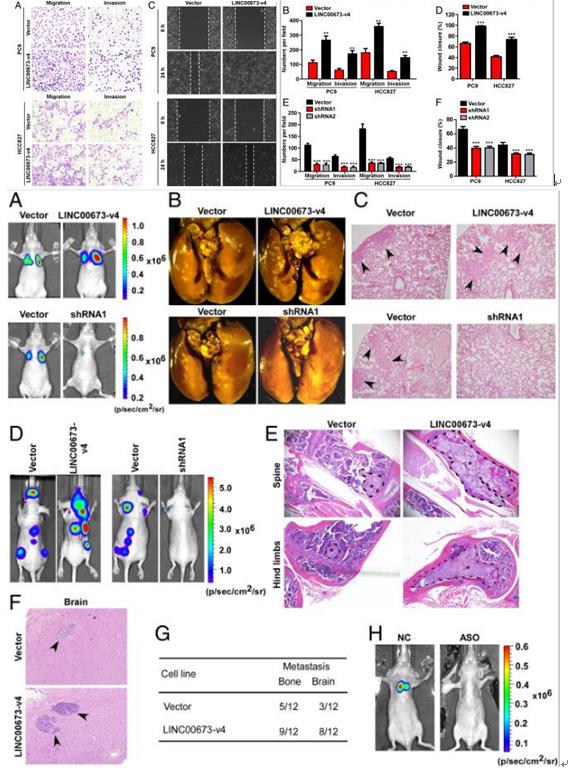
LINC00673-v4表達與LN轉移和LAD預后不良的強烈關聯,那么LINC00673-v4是否能夠促進LAD細胞的侵襲和遷移。在體外細胞系驗證中,transwell結果顯示LINC00673-v4的過表達顯著增加了LAD細胞的侵襲和遷移能力,劃痕實驗結果同上;當敲低LINC00673-v4是抑制細胞侵襲和遷移。
利用裸鼠肺癌轉移實驗模型在體內檢查LINC00673-v4的功能,體內實驗結果與體內實驗結果一致。為了進一步證實LINC00673-v4在LAD轉移中的功能,采用心內注射轉移模型。LINC00673-V4過表達的PC9細胞接種的小鼠中顯著增加骨和腦轉移,但敲低LINC00673-V4 PC9細胞降低。還利用LINC00673-v4的反義RNA鏈(LINC00673-v4 GapmeRs)直接注射到裸鼠尾靜脈來治療LAD轉移模型,治療組腫瘤轉移性明顯下降。結果表明LINC00673-v4 GapmeRs代表了LAD轉移的潛在治療方法。這些數據表明LINC00673-v4是LAD細胞侵襲,遷移和轉移的強啟動子分子。
三、LINC00673-v4激活WNT /β-連環蛋白信號
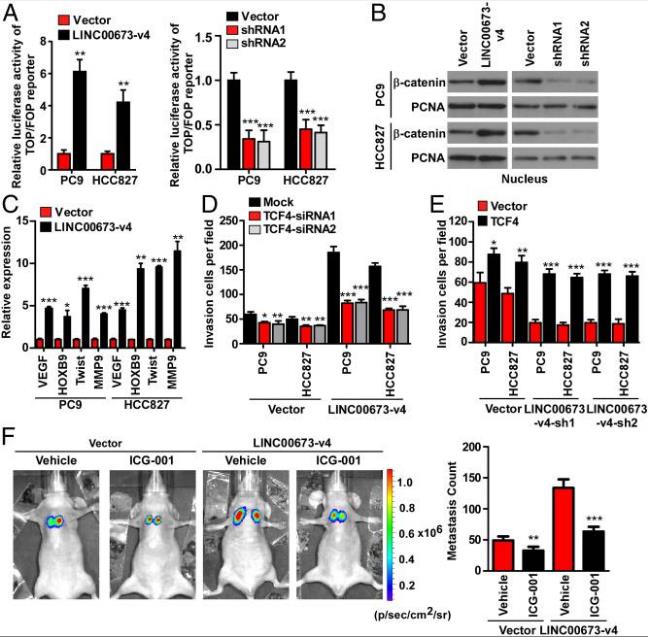
為了進一步闡明LINC00673-v4在WNT /β-連環蛋白信號傳導中的作用,分別在LINC00673-v4過表達和敲低的LAD細胞中進行熒光素酶測定實驗。TCF / LEF活性過表達LINC00673-V4細胞中顯著增加,并且在敲低LINC00673-V4細胞中顯著降低。LINC00673-V4的過表達促進β連環蛋白的細胞核積聚,而敲低LINC00673-V4抑制β連環蛋白細胞核積聚。接下來檢查了LINC00673-v4對WNT /β-連環蛋白信號傳導下游入侵相關基因表達的影響。VEGF、HOXB9、Twist和MMP9表達水平,在過表達LINC00673-V4細胞中顯著增加,并且在敲低LINC00673-V4細胞中顯著降低。
接下來研究了WNT /β-連環蛋白激活是否在介導LINC00673-v4誘導的細胞侵襲中發揮作用。首先,通過敲低TCF4或LEF1抑制WNT /β-連環蛋白信號傳導對LINC00673-v4過表達細胞侵襲的影響,LINC00673-V4過表達的細胞侵襲時因TCF4或LEF1被敲低而減弱。TCF4或LEF1敲低導致細胞侵襲減少,但不如過表達LINC00673-v4的LAD細胞顯著。其次,在LINC00673-v4敲除的細胞系中驗證TCF4或LEF1過表達拯救LAD細胞侵襲的能力。在過表達TCF4或LEF1空載體轉染的LAD細胞中,增加了LAD細胞侵襲,并且這些影響可能在LINC00673-V4-沉默LAD細胞中進一步增強。最后通過使用WNT /β-連環蛋白信號轉導抑制劑進一步確定活化的WNT /β-連環蛋白信號是否在小鼠模型中在LINC00673-v4介導的前期轉移作用中發揮作用。體內實驗顯示Wnt信號傳導抑制劑ICG-001對PC9-LINC00673-v4和PC9-Vector轉移能力下降明顯。但ICG-001對PC9載體細胞肺接種成瘤的抑制作用不如過表達LIN900673-v4的PC9細胞。這些結果表明,LINC00673-v4可促進WNT /β-連環蛋白信號傳導的活性,從而增強LAD細胞的侵襲和轉移。
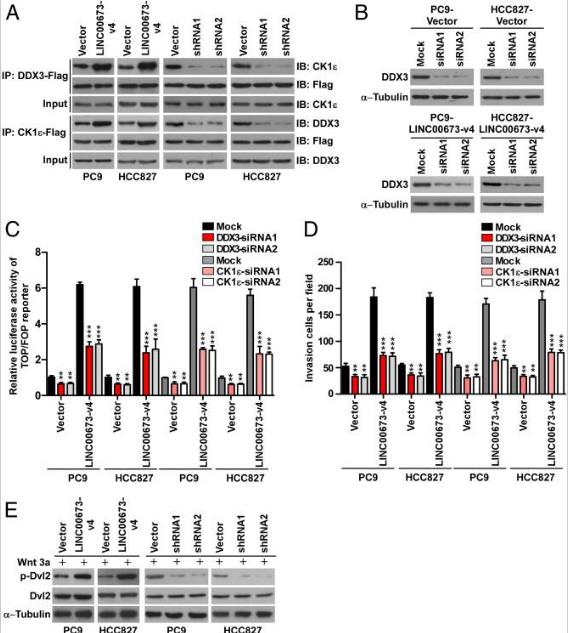
四、LINC00673-v4與DDX3和CK1ε互作
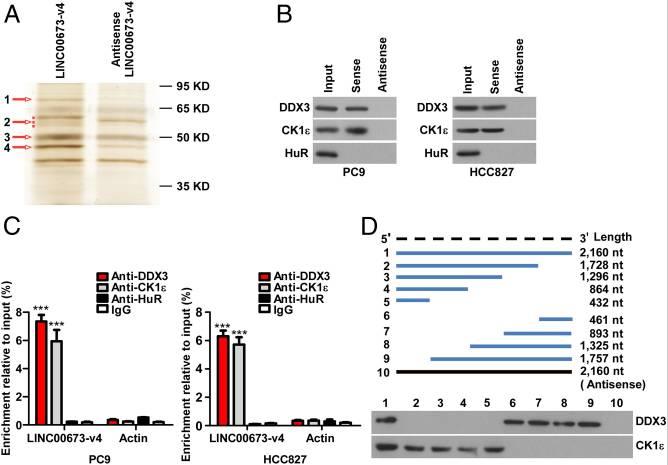
許多lncRNA通過與蛋白質分子的物理相互作用發揮其生物學功能。為了研究LINC00673-v4在調節WNT /β-連環蛋白信號傳導中的作用的分子機制,通過鑒定LINC00673-v4的細胞內結合蛋白開始研究。將生物素化的LINC00673-v4或其反義RNA與PC9細胞裂解物一起溫育,然后進行pull-down實驗。對差異條帶進行質譜分析, CK1ε是4個差異條帶中排名靠前的LINC00673-v4相互作用蛋白,也在WNT /β-連環蛋白信號傳導中起重要作用。為了證實LINC00673-v4與CK1ε相互作用,我們使用CK1ε抗體進行RNA pull-down和免疫印跡,結果顯示在LINC00673-v4蛋白復合物中檢測到CK1ε,但在對照樣品中未檢測到CK1ε。而且,在UV交聯后通過RIP測定進一步驗證了直接相互作用。進行RNA pull-down之后進行后UV交聯免疫印跡和RIP測定,結果表明,LINC00673-V4也直接與DDX3相互作用。
為了確定LINC00673-v4的分子內區域與相互作用中涉及的兩種蛋白質相互作用,LINC00673-v4的八個片段(1-1728 nt,1-1296 nt,1-864 nt,1-432 nt,1729-2189 nt ,1297-2189 nt,865-2189 nt和433-2189 nt體外轉錄和生物素化,并用于來自PC9細胞的總蛋白質提取物的pull-down測定。發現LINC00673-V4的1729-2160個核苷酸段與DDX3相互作用,而LINC00673-V4的1-432 NT段與CK1ε相互作用。這些數據表明LINC00673-v4是DDX3和CK1ε的直接交互結合配偶體。
五、LINC00673-v4在WNT /β-Catenin信號通路中作為模塊化支架起作用
為了進一步了解LINC00673-v4與DDX3和CK1ε的結合是否加強了DDX3和CK1ε之間的相互作用,進行了o-IP實驗,發現DDX3和CK1ε可以相互作用并且過表達LINC00673- V4增強DDX3和CK1ε的相互作用,而LINC00673-v4敲低減弱了LAD細胞系中的這種相互作用,表明LINC00673-v4直接結合DDX3和CK1ε并加強它們的相互作用。
為了驗證LINC00673-v4是否與DDX3和CK1ε相互作用是激活WNT /β-連環蛋白信號傳導所必需的。在過表達LINC00673-v4的LAD細胞中敲除了DDX3或CK1ε,發現通過敲除DDX3或CK1ε可以抑制LINC00673-v4誘導的WNT /β-連環蛋白激活和LAD細胞侵襲能力的增加。還研究了敲低DDX3或CK1ε對對照載體轉導細胞的影響。DDX3或CK1ε敲低導致對照載體轉導的細胞中WNT /β-連環蛋白激活和細胞侵襲減少,但不如過表達LINC00673-v4的LAD細胞顯著。還觀察到DVL的磷酸化在LINC00673-V4過表達LAD細胞增加,而沉默LINC00673-V4表達降低DVL磷酸化。總之,這些數據表明LINC00673-v4可能確實充當DDX3和CK1ε復合物的模塊化支架以激活WNT /β-連環蛋白信號傳導。
六、LINC00673-v4與LAD中的WNT /β-連環蛋白信號臨床相關
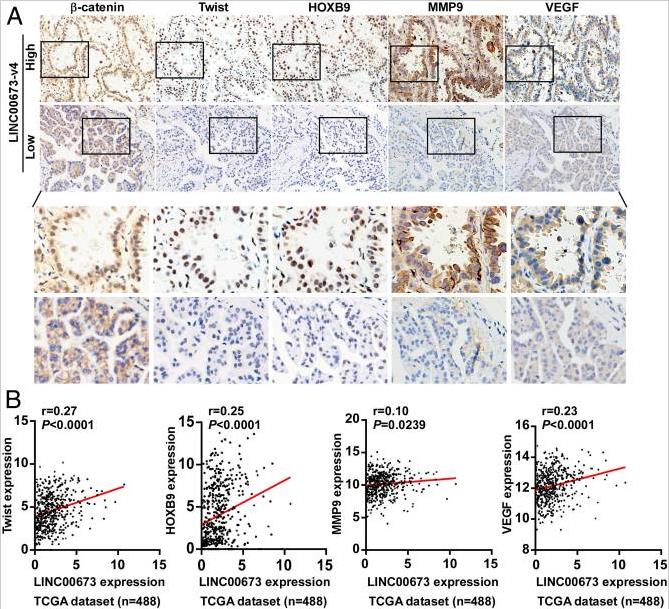
進一步研究上述發現是否與臨床相關,我們采用LAD臨床標本檢查LINC00673-v4的表達及其與WNT /β-連環蛋白激活標志的相關性。LINC00673-V4水平和核β連環蛋白(R = 0.238,P = 0.009)、Twist (r = 0.205, P = 0.025)、HOXB9 (r = 0.197, P = 0.032)、MMP9 (r = 0.191, P = 0.038)和 VEGF (r = 0.202, P = 0.028) 的表達正相關。此外,分析了在TANRIC數據庫中收集的LAD患者的數據,LINC00673-v4高表達與Twist 、HOXB9、MMP9和 VEGF 成正相關。這表明在LAD病人,LINC00673-V4臨床有助于WNT的激活/ β-連環蛋白信號通路,導致核β-連環蛋白,VEGF,Twist,HOXB9和MMP9的表達增加。
結論
NC00673-v4在LAD中的臨床,功能和機制意義,LINC00673-v4及其在WNT /β-連環蛋白信號傳導中的調節作用對于LAD的侵襲性行為至關重要,而LINC00673-v4可能是一種LAD治療潛在的有效目標。






