circRNA的過去,現在和未來
circRNA在真核生物中高豐富,其中許多是進化保守的。在后生動物中,circRNA以組織特異性方式表達,高度穩定,并且隨著年齡在神經組織中累積。由于反向剪接與線性剪接的競爭,circRNA生物發生可以調節順式線性RNA的衍生物。例如,最新報道證明了某些circRNA的功能:circRNA可以與microRNA相互作用,其中某些circRNA被翻譯,可以調節免疫應答和行為。
6月份,InesLuciaPatop等人發表一篇“Past,present,andfutureofcircRNAs”的SCI文章,回顧了有關動物circRNA的當前知識,并對潛在circRNA功能,起源概念以及該領域未來可能研究方向進行了總結。
一、circRNA的形成-反剪接機制
1.外顯子衍生的circRNA是通過反向剪接這類機制產生的,其中5’端剪接供體結合上游的3’端剪接位點。5’與3’端形成磷酸二酯鍵,進而產生了circRNA分子(圖1)。
circRNA在大多數真核生物中由剪接體產生的,但在酵母,植物和變形蟲之間產生的機制存在差異。在植物中,circRNA由側翼為長內含子的區域產生,側翼為長內含子的互補序列非常短或完全沒有。在古細菌中,circRNA的環化過程不依賴剪接體,其中16%左右來自編碼基因,少部分來自外顯子。在后生動物中,circRNA的產生源于錯綜復雜的可變剪接。由于一些基因產生許多可變剪接亞型和circRNA,這表明反向剪接和選擇性剪接可能在功能上相關。(全外顯子型的circRNA;內含子和外顯子組合的EICircRNA;內含子組成的套索型ciRNA;由病毒RNA基因組、tRNA、rRNA、snRNA等環化產生的circRNA)
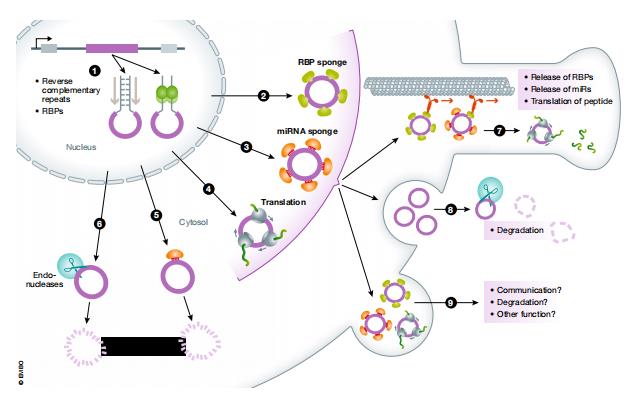
圖1.circRNAs概覽圖。circRNA可以在反向互補重復序列或RNA結合蛋白的幫助下產生并從細胞核輸出(1)。在細胞質中circRNA可能受多種因子的束縛,可以是RNA結合蛋白(2),載有miRNA作為海綿或支架的Argonaute蛋白(3),核糖體(4),Argonaute蛋白或者內切核酸酶(5)導致circRNA降解(6)。circRNA與因子非降解結合,其復合物可以在細胞質中擴散或者被主動轉運到細胞的特定區域[例如突觸(7)],從而釋放其結合的因子或被翻譯。囊泡中的circRNA或circRNA因子復合物被釋放到細胞外空間以降解circRNA(8)。然而受囊泡保護的circRNA或circRNA復合物可以到達其他細胞或組織,充當信使分子或執行其他未知功能(9)。
2.序列與蛋白質驅動外顯子環化
外顯子衍生的circRNA的產生至少依賴其中一種機制:具有長反向重復的內含子或與RBP的結合。這兩種機制使circRNA側翼內含子彼此非常接近。相比連接位點的規范剪接事件,circRNA的側翼內含子難以有效剪接,這表明線性剪接是默認的剪接過程(2016b)。此外,可環化的外顯子在果蠅,人,小鼠,豬和植物中都有長內含子(Jeck等,2013;Guo等,2014;Westholm等,2014;Veno等,2015;Ye等。al,2015;Zhao等,2017)。其中很多內含子顯示廣泛的反向互補性(Capel等,1993;Jeck等,2013;Liang&Wilusz,2014;Zhang等,2014)。此外,內含子中反向互補重復的存在可用于預測哪些外顯子可能發生環化(Ivanov等,2015)。根據分析的物種反向互補元素顯示不同的基序富集。在人類中,88%是ALU重復,而在小鼠中,22%是ALU樣重復,而在蠕蟲中,只有11%富含一種特定基序(Jeck等,2013;Ivanov等,2015)。這些基序之間的序列比對指出了可能的進化關系(Ivanov等,2015)。有趣的是,ALU元件被認為起源于進化過程中的轉座子(Quentin,1992)。此外,位于內含子之間或之內的反向元件分布對circRNA的產生豐度和類型有影響(Zhang等,2014)。例如,在人成纖維細胞中表達的僅有40%的circRNA表達,其側翼內含子中含有ALU重復的基因,其中20%也是互補的(Jeck等,2013)。在豬皮質中表達的30%的circRNA在可環化外顯子側翼的內含子中具有互補的短分散的序列(Veno等,2015)。在秀麗隱桿線蟲中觀察到的38%(Ivanov等,2015)。在可環化外顯子側翼的許多內含子中不存在反向重復,這強烈表明外顯子環化存在其他機制。事實上,剪接因子MBL介導了一種替代機制(Ashwal-Fluss等,2014)。MBL與幾個高度保守的內含子位點結合,促進其自身第二外顯子的環化。有趣的是,果蠅MBL基因產生mRNA編碼幾種蛋白質,其中只有MBL-C和MBL-A才促進外顯子環化。可以想種型MBL-C和MBL-A促進內源性人MBNL1基因的環化,表明了存在高度保守的機制(Ashwal-Fluss等,2014)。circMb1也強烈結合MBL蛋白,指出這兩個分子之間存在調節回路。哺乳動物兩種MBL同源物(MBNL1和MBNL2)在小鼠和人中產生circRNA(Salzman等,2012;RybakWolf等,2015)。雖然與果蠅相比,這些circRNA表達水平相對較低,但其含有兩倍以上的MBL/MBNL1/MBNL2蛋白結合位點,在不同的物種保持MB(N)L/circMbl(n)l比例(Ashwal-Fluss等,2014)。有趣的是,位于MBL第二外顯子側翼的內含子包含很可能的短反轉序列穩定內-內相互作用,但可能太弱而不能在沒有MBL結合的情況下促進外顯子環化(Ashwal-Fluss等,2014)。這有力地表明MBL通過與側翼內含子結合并促進內含子-內含子相互作用來促進環化。MBL分子可以二聚化,將外顯子的兩端結合在一起以允許circRNA形成(Yuan等,2007)。其他RBP,如QKI,FUS和ESRP1,也可以調節外顯子環化。QKI通過與環化外顯子周圍的內含子序列結合,在人細胞培養物的上皮-間充質轉化過程中促進全球circRNA的產生(Conn等,2015)。有趣的是,像MBL一樣,QKI可能會二聚化促進環化(Teplova等,2013)。FUS規定通過與特定外顯子-內含子連接結合,在小鼠胚胎干細胞衍生的運動神經元中形成circRNA(Errichelli等,2017)。此外,剪接因子ESRP1通過與存在于可環化外顯子側翼的內含子中的特定位點結合來介導circBIRC6的環化(Yu等,2017)。最后,果蠅中漆酶-2衍生的circRNA的生物合成受不同RBP的組合調節,例如異質核核糖核蛋白(hnRNP)和SR蛋白,表明給定外顯子的環化效率可能是由于幾種信號的整合(Kramer等,2015)。綜上所述,內含子長反向重復和與RBP的結合(并且可能是二聚化)促進內含子-內含子相互作用,導致circRNA形成。通過內含子-內含子相互作用促進環化,有部分原因線性剪接的空間抑制。在這種情況下,通過促進或破壞RNA結構的因子,以及影響內含子-內含子相互作用,可以影響circRNA的生物合成。RNA解旋酶DHX9通過破壞二級結構來限制circRNA的產生,例如基于ALU反向重復的二級結構(Aktas等,2017)。DHX9直接與ADAR的干擾素誘導型同種型(p150)相互作用,該復合物負責破壞RNA二級結構,包括許多可促進外顯子環化的結構。有趣的是,DHX9下調檢測到的circRNA的數量增加了一倍(約26,000到~50,000).這似乎是一種減少circRNA廣泛產生的校正機制,并表明一些circRNA只不過是“加工缺陷”或拼接噪音。然而,這也表明甚至在DHX9存在下產生的circRNA的潛在需求。涉及dsRNA結構出現的特定生理情況也可以改變circRNA生物發生。例如,免疫應答因子NF90和NF110(Patin等人,2015)調節circRNA產生。有趣的是,這些蛋白質在感染時與病毒RNA結合并與轉錄過程中形成的dsRNA結構相互作用。這種結合似乎穩定了這種瞬時RNA雙鏈體并促進了一部分circRNA的反向剪接(Li等,2017a)。有趣的是,NF90結合位點是選擇性的富含內含子的ALU基序,支持circRNA形成外顯子。因此,這些外顯子的環化也可以進行ADAR和/或DHX9控制。此外,模擬病毒感染的聚(I:C)(聚肌苷:聚胞苷酸)刺激促進NF90/NF110向胞質溶膠的輸出。在這些條件下,通過NF90/NF110的結合產生的circRNA被下調(Li等,2017a)。NF90/NF110不僅結合細胞核中的新生circRNA,還結合細胞質中的至少兩個circRNA(circPOLR2A和circDHX34)。在聚(I:C)處理或水泡性口炎病毒感染時,兩種circRNA與NF90/NF110的相互作用減少。對于其他circRNA也可能是這種情況。因此,circRNA可能觸發NF90/NF110的釋放,使其在病毒感染時與病毒RNA結合(Li等,2017a)。RIG-1是一種檢測dsRNA并觸發抗病毒細胞因子產生的蛋白質(Yoneyama和Fujita,2008),改變了HeLa細胞中的circRNA產生。我們對促進、干擾或調節circRNA形成的機制的理解在未來幾年中可能會增加。評估產生circRNA的機制以及進化保守程度是非常有趣的。此外,人們想知道具有反式功能的circRNA是否由特定類型的機制產生。
3.circRNA生物合成的調節
circRNA由RNA聚合酶II轉錄并由剪接體產生。重要的是,形成circRNA的許多外顯子不是可變剪接的,由于CircRNA來源于mRNA前體,mRNA前體在加工過程中可以進行典型的線性剪切產生mRNA,也可以發生非典型剪切產生CircRNA。研究發現提高典型線性剪切的效率會導致產生CircRNA的數目顯著減少,當外顯子側翼的內含子長度比較長時,發生典型線性剪切的效率顯著下降,而發生環化的效率顯著提高,說明轉錄時CircRNA可以與mRNA前體發生剪切競爭。
4.circRNA的降解
circRNA沒有游離末端,因此許多規范的RNA衰變途徑無法獲得。使用4-硫尿苷代謝標記對細胞培養物中的60個circRNA進行的體外研究表明,大多數測定的circRNA比其線性對應物具有更長的半衰期(18.8-23.7h)(4.0-7.4h;Enuka等,2016)。其他研究支持這一發現(Ashwal-Fluss等,2014;Zheng等,2016;Liang等,2017)。circRNAs在體內可能具有更長的半衰期,特別是在不分裂的細胞類型中。實際上,大腦中circRNA的年齡依賴性積累可能是由于這些分子的高穩定性。反之亦然,似乎circRNA不會在具有高增殖率的組織中積累(Bachmayr-Heyda等,2015)。這可能是由于如果增殖高于產量,可以稀釋circRNA。關于circRNA在體內降解的機制和速率知之甚少。理論上,circRNA降解可以通過核酸內切酶啟動,然后通過外切核酸酶和內切核酸酶的組合。在體外使用RNaseH和Rrp44顯示了通過核酸內切酶活性進行circRNA降解的第一個提示(Mackie,1998;Schaeffer等,2009)。在這兩種情況下,作者測試了人工環狀RNA構建體,并且這些circRNA種類的切割非常低。迄今為止,小RNA介導的circRNA降解是最佳表征的circRNA降解途徑。然而,除了基于人工shRNA/siRNA的系統之外,迄今為止唯一的例子(Jeck等,2013;Legnini等,2017;Pamudurti等,2017;Yu等,2017),是miR-671對CDR1as的降解(Hansen等,2011)。值得注意的是,circRNA中的miRNA結合位點幾乎與miRNA完全互補。CDR1as的量由miR-671通過AGO2介導的降解直接調節(Hansen等,2013)。CDR1as,miR-671及其結合位點是高度保守的(Hansen等,2013),并且該位點的缺失導致CDR1a水平的顯著增加(Kleaveland等,2018)。有趣的是,CDR1as水平可能通過切片調節miR-7,這也取決于miR-671(Kleaveland等,2018)。最近的一項研究表明RNA修飾N6-腺苷甲基化(m6A)促進內切核酸酶的募集,所述內切核酸酶可能降解circRNA(Park等,2019)。另一項研究發現在HeLa細胞中聚(I:C)刺激或腦心肌炎病毒(EMCV)感染后circRNA的全球降解(Liu等,2019)。兩種處理均導致內切核糖核酸酶RNaseL的活化和circRNA的降解。有趣的是,一部分circRNA結合并抑制PKR(蛋白激酶dsRNA激活),這是一種對病毒感染反應的激活劑。此外,作者發現自發性RNaseL激活,PKR磷酸化增加和外周血中circRNA減少。
二、circRNA的特性和特征
1.circRNA的進化保守性問題(圖2)
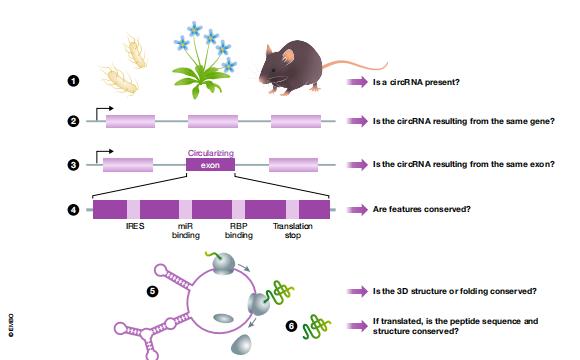
圖2:circRNAs進化保守的多個水平。為了確定兩種或更多種生物之間的circRNA的保守水平,我們提出了幾個一般性問題:1.兩種生物體中是否存在circRNA?2.在兩種生物中,同一(同源或直系同源)基因是否產生circRNA?3.circRNA是否由相同的外顯子產生?4.潛在的特征是否得到保護?這意味著可能存在RBP和miRNA結合位點,IRES和平移終止的存在。5.是否保留了潛在的3D結構?6.如果翻譯了circRNA,那么肽序列同源物也是如此?
2.組織,發育階段和亞細胞位置特異性表達
宿主circRNA的基因高度富集腦相關基因(Ashwal-Fluss等,2014; Westholm等,2014; Rybak-Wolf等,2015; You等,2015)。因此, circRNA在神經組織中高度富集并不奇怪。這種CNS特異性富集似乎 是所有研究物種中circRNA的一般特征(Guo等,2014; Westholm等,2014; Rybak-Wolf等,2015; You等, 2015)。值得注意的是,腦內circRNA的表達具有高度特異性,并 且在許多情況下,與宿主基因產生的線性同種型的表達無關 (Rybak-Wolf等,2015; Veno等,2015; You等, 2015年)。 CNS中circRNA的顯著富集可能是由于一種或多種因素。首先,大 腦,更具體地說,神經元在體內顯示出最高的可變剪接率(Yeo等, 2004; Pan等,2008),并且circRNA生物發生可以被定義為特定類 型的可變剪接。另一個有趣特征是它們的亞細胞定位。與在轉錄位點附近定位的異常剪接產物不同,circRNA主要是細胞質的(Nigro等,1991;Capel等,1993;Cocquerelle等,1993;Salzman等,2012;Memczak等,2013;Werfel等)。al,2016)。circRNAs對軸突,樹突和突觸的定位也很有趣。目前尚不清楚觀察到的積累是由于定向轉運還是由于這些分子在這些區室中的擴散和保留(例如,通過與膜蛋白結合或僅僅不可能返回)。進一步的遺傳和生物化學實驗應該揭示驅動神經元內circRNA的亞細胞定位的機制。
3.circRNAs的翻譯
Yang等(2017)鑒定了由癌細胞系和人成纖維細胞中的一部分circRNA產生的幾種小肽(Yang等,2017)。有趣的是,作者發現當腺苷甲基化時,起始密碼子上游的RRACH基序(R=G或A;H=A,C或U)增強了circRNA的轉錄(Yang等,2017)。大多數預測的肽可能與circRNA宿主基因編碼的蛋白質的N-末端區域相同。這些截短的蛋白質可能作為其線性mRNA表達的全長對應物的競爭者。一種可能的情況可能是像Mef2這樣的轉錄因子。它的N-末端DNA結合結構域可能是從circRNA表達的(Legnini等,2017),可能與全長Mef2競爭DNA結合位點,甚至可以自己發揮作用(Heetal,2011;Legnini)等,2017)。最直接的假設是circRNA編碼的蛋白質本身具有功能。考慮到該領域的快速發展,我們期望在未來幾年內出現研究顯示circRNA翻譯和所得肽的生理影響。
4.circRNAs作為誘餌,轉運蛋白或支架
由于circRNA穩定,并與RBP結合,因此它們可以作為轉錄因子的誘餌或轉運蛋白。在一些情況下,circRNA和宿主基因的蛋白質產物之間可能存在直接或間接的串擾。
三、評估circRNA在體內的功能
1.發揮miRNA 海綿效應,circRNA 富含miRNA 的結合位點,可以阻止miRNA與3’端非編碼區與mRNA結合,即調控miRNA下游靶基因的表達。
2.調控蛋白結合(圖1)
3.調控基因轉錄
4.編碼蛋白
結論:
此文獻描述的研究表明,circRNA可以作為蛋白質的支架,可以募集其他RNA種類,并且通過miRNA的結合,可以影響特定mRNA的轉錄沉默,翻譯或衰變。神經元中circRNA的不對稱分布表明這些RNA在細胞中的定向轉運的可能性。circRNA可以編碼蛋白質。雖然大多數這些可能的蛋白質的生理功能尚未確定,但它們很可能會分享由轉錄本的線性形式編碼的全長蛋白質對應物的一些能力。作為旁注,circRNA的編碼能力和穩定性可用于需要產生肽的生物技術應用。隨著RNA技術穩步發展,我們預見到了一個偉大的發展未來幾年對circRNA領域的評價。進一步了解circRNA定位,運輸,活細胞降解,完整的circRNA相互作用組和單細胞分析是該領域的一些預期進展。






