肺癌治療的手段-AIF
凋亡誘導因子(AIF)不僅參與細胞凋亡,還在線粒體內發揮重要的功能,它通過線粒體呼吸鏈中復合物I的轉錄后調控,決定氧化磷酸化(OXPHOS)的速率。近些年,AIF被廣泛研究。今天小編就帶大家了解關于AIF調控氧化磷酸化支持肺癌的發展的文章AIF-regulated oxidative phosphorylation supports lung cancer development。

在本研究中,作者使用KrasG12D驅動的小鼠肺癌模型,通過AIF敲減、線粒體呼吸評估、糖酵解、WT或線粒體錨定的AIF重新表達和和肺癌轉錄組數據分析證明了AIF調控線粒體呼吸和OXPHOS,從而促進肺癌的進展。
結果:
1)減少AIF缺乏KrasG12D小鼠的肺癌
為了確定AIF在肺癌中的作用,我們將AIF fl/fl 小鼠與Lox-Stop-Lox-KrasG12D菌株雜交。Lox-Stop-Lox-KrasG12D小鼠在Cre缺失并誘導突變的KrasG12D等位基因后,逐步發展為非小細胞肺癌(NSCLCs),從上皮細胞增生到良性腺瘤和惡性腺癌。與對照組相比,KrasG12D驅動的肺癌模型中AIF的缺失顯著延長了存活時間(圖1a)。在所有時間點分析中,與對照相比,Aiffl / y KrasG12D小鼠肺中腫瘤區域的數量減少(圖1 b, c)。這些結果表明,AIF基因失活可顯著降低krasg12d驅動的肺癌發生。接下來我們評估了腫瘤的發生和肺癌的惡性進展。Ad5-CMV-Cre吸入4周后,微CT顯示Aiffl/y KrasG12D小鼠腫瘤病灶明顯減少,且在整個觀察期間均觀察到腫瘤病灶減少(圖1d)。

2)AIF的缺失會損害OXPHOS并破壞線粒體結構
由于AIF影響腫瘤的發生和早期發展,我們從Aiffl/y KrasG12D和AIF+/y KrasG12D胎鼠中分離出原代肺細胞,隨后用Ad5-CMV-Cre-eGFP感染培養細胞,激活KrasG12D表達,同時刪除AIF(圖2a)。正如之前研究中所預期的那樣,AIF的缺失也導致線粒體復合物I蛋白的減少(圖2a)。然后分析AIF突變原代肺細胞的耗氧量(OCR),以評估線粒體呼吸。Aiffl/y KrasG12D細胞在較低的基礎水平上消耗氧氣,產生更少的ATP,并且在對FCCP的響應中表現出有限的OCR增加,導致最大呼吸容量降低(圖2 b,c)。
在體內Ad5-CMV-Cre感染6周后,我們從Aiffl/y KrasG12D和Aif+/y KrasG12D胎鼠中分離出原代轉化的肺細胞。值得注意的是,小鼠感染的病毒滴度是正常濃度的5倍,以確保大多數肺細胞被感染(圖2d)。與我們的短期培養相似,體內Ad5- CMV-Cre處理導致基礎呼吸、ATP生成、最大呼吸和備用呼吸能力減少(圖2e)。我們還對Ad5-CMV-Cre吸入16周后Aiffl/y KrasG12D和Aif+/y KrasG12D小鼠新分離腫瘤組織中的線粒體進行了表征。具有AIF活性的腫瘤細胞與缺乏AIF的腫瘤細胞線粒體數量無明顯差異;然而,Aiffl/y KrasG12D腫瘤細胞線粒體腫脹,嵴結構明顯減少,排列紊亂(圖2f)。因此,AIF的缺失不僅會導致OXPHOS的普遍受損,還會導致線粒體形態異常。
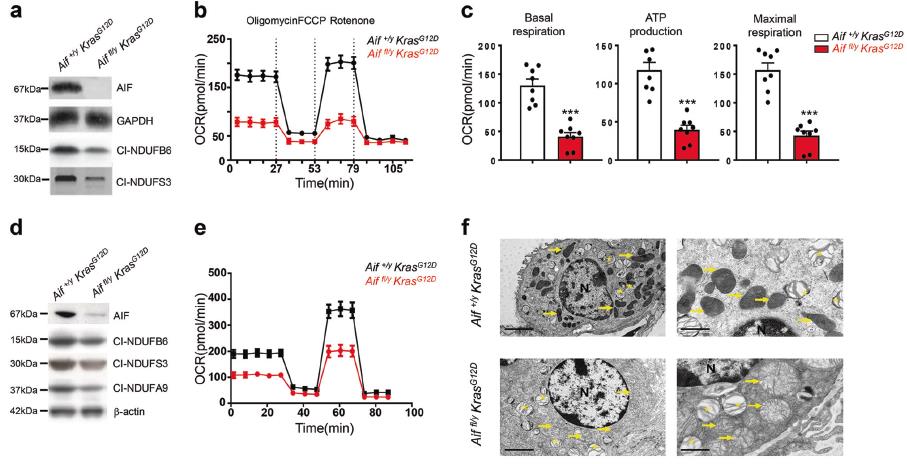
3)AIF缺乏增強糖酵解和對葡萄糖缺乏的敏感性
在添加葡萄糖刺激糖酵解后,Aiffl/y KrasG12D肺細胞的基礎細胞外酸化率高于Aif+/y KrasG12D對照細胞(圖3a)。添加寡霉素后,通過OXPHOS抑制ATP產生,Aiffl/y KrasG12D細胞和Aif+/y KrasG12D細胞的糖酵解活性均增加,但Aif+/y KrasG12D細胞的糖酵解活性明顯增加(圖3 b)。在體外Ad5-mSPC-Cre處理的Aiffl/y KrasG12D肺細胞中,糖酵解也增加了(圖3 c,d)。對照Aif+/y KrasG12D細胞不受2-DG 72 h孵育的影響,,而Aiffl/y KrasG12D細胞死亡率增加(圖3e)。同樣,葡萄糖缺乏對Aif+/y KrasG12D細胞無明顯影響,但影響Aiffl/y KrasG12D細胞的生長(圖3f)。最后,我們觀察到在葡萄糖缺乏條件下培養的Aiffl/yKrasG12D肺細胞內ATP水平顯著下降(圖3g)。這些結果表明AIF的缺失導致OXPHOS缺乏癥和細胞代謝向糖酵解的轉變。Aiffl/y KrasG12D肺細胞中,OXPHOS對ATP合成的貢獻較小,主要由糖酵解提供,而Aif+/y KrasG12D細胞中的ATP大部分由OXPHOS生成。
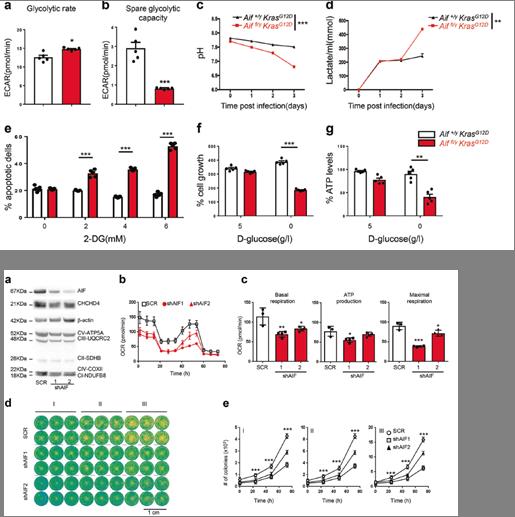
4)穩定的AIF缺失會損害KRAS WT和KRAS突變的肺癌細胞的克隆潛能和增殖
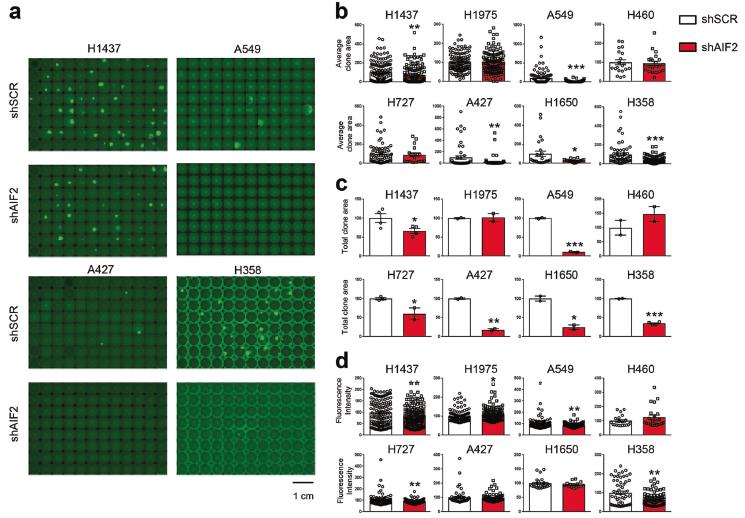
在KRAS突變的NSCLC A549細胞中,AIF的穩定下調抑制了CHCHD4的表達,并導致呼吸鏈蛋白如CIII-UQCRC2、cii - coxii和CI-NDUFB8的減少以及OXPHOS、ATP生成、克隆潛能和增殖的減少。另外,AIF敲除顯著降低了H1437、H727、A427、H1650、H358以及A549細胞的克隆能力(圖5)。
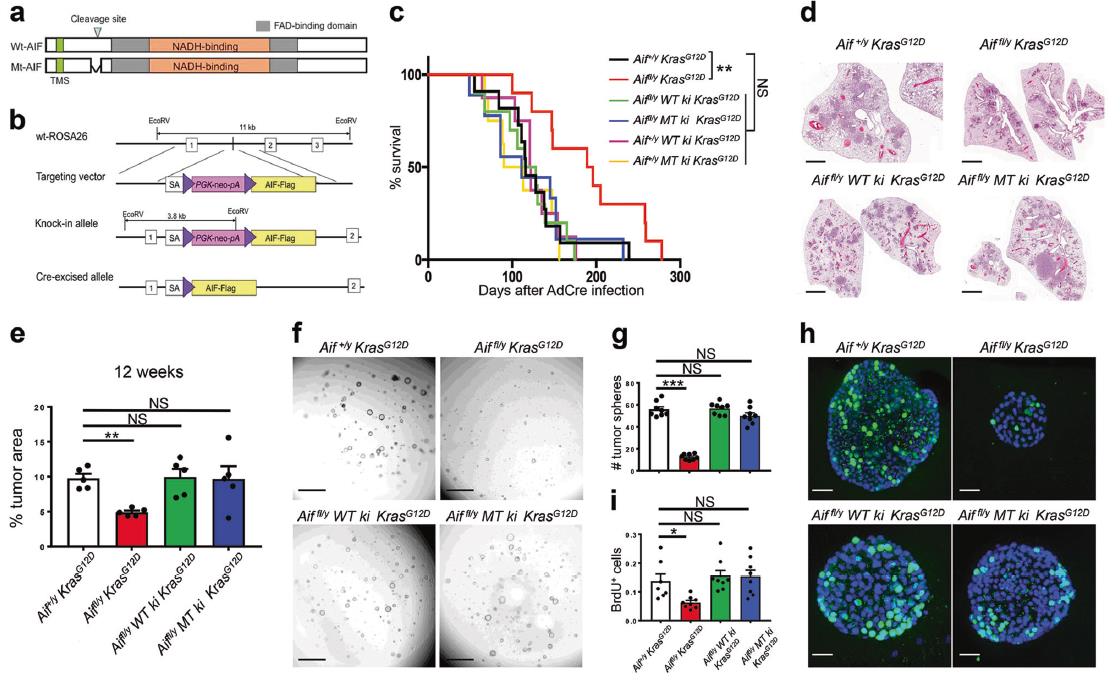
5)重新表達WT或線粒體錨定的AIF可恢復肺癌敏感性
Aiffl/y KrasG12D小鼠在吸入Ad5-CMV-Cre后存活的時間明顯長于對照組小鼠。在敲除AIF的小鼠中重新表達WT AIF后,存活率顯著降低。而且線粒體錨定突變體AIF替代內源性AIF也恢復了Aiffl/y KrasG12D小鼠的癌癥表型(圖6c)。另外WT或突變AIF的重新表達導致肺腫瘤負荷增加(圖6d,e)。接下來為了進一步研究AIF和OXPHOS在腫瘤細胞增殖和腫瘤干細胞樣特性中的功能相關性,我們采用最近開發的3D腫瘤球體培養法,從Ad5-mSPC-Cre感染6周后的Aif+/y KrasG12D、Aiffl/y KrasG12D、Aiffl/y WT ki KrasG12D、Aiffl/y MT ki KrasG12D小鼠中分離純化的原發肺細胞,進行細胞培養。在從每個基因型中植入相同數量的腫瘤細胞后,我們發現Aiffl/y KrasG12D小鼠與Aif+/y KrasG12D小鼠相比,來自Aiffl/y KrasG12D小鼠的腫瘤球體數量顯著減少。WT和突變型AIF的重新表達幾乎完全恢復了莖樣性質,形成腫瘤球形,達到AIF +/y KrasG12D對照水平(圖6f,g)。接下來,我們通過BrdU標記來確定這些腫瘤球的增殖能力。再次,我們觀察到Aiffl/y KrasG12D腫瘤球體中陽性細胞明顯少于AIF WT、AIF WT敲入和AIF突變敲入腫瘤球體(圖6h,i)。
6)WT或線粒體錨定AIF的修復可消除線粒體呼吸缺陷
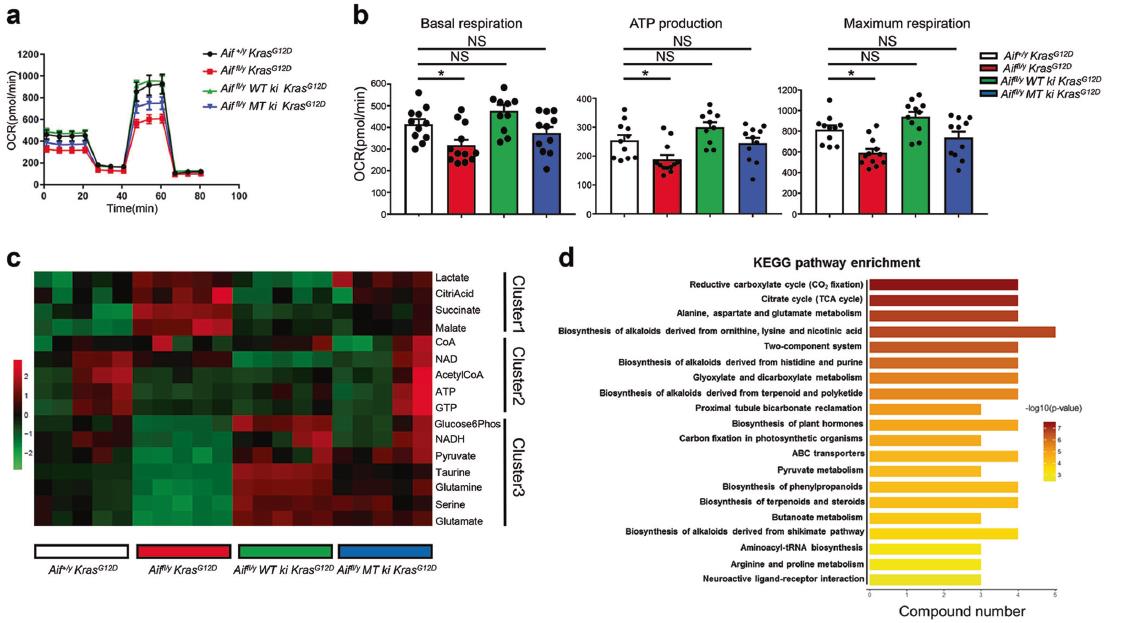
將WT或線粒體錨定的AIF重新引入Aiffl/y KrasG12D肺細胞中,可將其呼吸能力提高到與AIF +/y KrasG12D對照組相當的水平(圖7a, b)。另外,與生物能量譜一致,AIF缺陷細胞所含PEP和NADH明顯減少,但乳酸含量高得多(圖7c),這表明AIF耗盡后OXPHOS確實受到抑制。另外,三羧酸循環的中間代謝物,包括檸檬酸、蘋果酸和琥珀酸,在AIF缺乏的細胞中大量增加(圖7c),這與KEGG富集分析一致(圖7d)。
7)AIF在人類肺腫瘤中經常過度表達,高AIF表達與低生存率有關
最后,我們通過分析已發表的數據集,探討AIF在人類肺癌中的臨床意義。肺癌和不同肺癌亞型的轉錄組研究表明,與正常組織相比,肺癌組織中AIF mRNA水平顯著上調(圖8a)。為了在蛋白水平上驗證這一發現,我們用免疫組織化學方法研究了AIF在人類肺癌樣本中的表達。與之前的研究結果一致,我們觀察到Kras突變和Kras WT肺癌患者的腫瘤組織中AIF表達均高于正常肺組織(圖8b)。另外,我們發現,在三個不同的NSCLC群體中,不僅AIF,而且編碼復合物I亞基或其組裝因子的絕大多數基因在NSCLC組織中都比正常相鄰肺組織明顯過表達(圖8c)。因此,當我們用Ad5-mSPC-Cre感染Aif+/y和Aif+/y KrasG12D小鼠的肺細胞時,在激活KrasG12D 8天后檢測到AIF表達顯著誘導;然而,在表達WT Kras的非轉化性肺細胞中沒有觀察到這種效應(圖8d)。此外,我們通過分析TCGA數據集中的RNAseq數據,評估了AIF表達與總生存率之間的相關性。發現無論KRAS突變情況如何,AIF高表達與預后不良呈負相關(圖8e)。同樣,免疫組化檢測顯示,NSCLCs表達低水平AIF蛋白的患者比AIF高腫瘤患者生存時間更長(圖8f),這與AIF高表達與預后不良相關的結論一致。






