推波助瀾外泌體——腫瘤微環境與肝癌發展
關于外泌體與腫瘤發生發展關系之間的報道已有不少,而腫瘤微環境對腫瘤影響的研究也一直在進行。今年5月,Dr.Qin Wu等人在雜志《Journal of Hematology & Oncology》上發表了一篇題為“Exosome-mediated communication in the tumor microenvironment contributes to hepatocellular carcinoma development and progression”的文章,綜合近些年來的研究,就外泌體、腫瘤微環境與肝癌發生發展之間的關系做了詳細的總結,為針對外泌體設計新型靶向抗腫瘤藥提供了理論參考
摘要:
腫瘤微環境(TME)是肝癌細胞(HCC)發生、發展、侵襲和轉移的重要內在條件之一。作為腫瘤-宿主相互作用的新發現組成部分,外泌體越來越多的被認為是TME中信息專屬媒介,是參與腫瘤發生微環境構建的關鍵分子實體。然而,關于TME內外泌體交流系統在HHC發展進程中的作用仍有很多未知之處。這篇文章聚焦于TMC在HHC中的作用和可能作用機制,并闡述了TME中基于外泌體的免疫調控對HCC的促進作用。HCC涉及多個過程,包括腫瘤存活、生長、血管生成、侵襲和轉移。研究還討論了外泌體通過構建適合HCC的TME,如提供能量、傳遞原細胞信號和逃避抑制信號,在HHC過程中通過發揮的特殊作用。除此之外,外泌體通過改變內皮細胞的生物學特性誘導血管生成,并直接調控促血管新生因子和促滲透因子。此外,外泌體可能通過上皮-間質轉化、細胞外基質降解和血管滲漏引導HCC轉移侵襲。最后,文章總結了外泌體在HCC微環境中的治療作用,并嘗試為針對這些機制設計的現代抗腫瘤藥提供理論參考。
2 什么是腫瘤微環境?
腫瘤微環境(TME)是腫瘤生長的細胞環境。除腫瘤細胞外,TME還包括多種細胞類型、細胞外基質(ECM)、生長因子、蛋白水解酶及其抑制劑和信號分子。
2 腫瘤微環境有什么作用?
TME影響腫瘤生長、轉移和最終預后。TME的基礎性作用是和惡性細胞進行動態的相互作用。TME在肝細胞癌(HCC)的發病機制中起重要作用。事實上,通過提供、抑制或刺激生長信號,TME是HCC發展和進展的重要調節劑,也是確定潛在治療藥物靶點的來源。
2 關于外泌體:
HCC細胞與周圍的TME的交互基于復雜的網格系統,細胞間信號傳導方式主要為直接細胞間接觸和通過分泌因子進行的細胞間通訊。
在外泌體產生過程中,外泌體中充滿了ncRNA,這些ncRNA水平地從供體細胞轉移到受體細胞。外泌體可以攜帶生物分子從組織到體液。這些特性有助于外泌體在細胞間通訊中發揮作用。信號分子在附近細胞和遠處細胞之間穿梭。外泌體表面含有大量與抗原呈遞相關的分子。在體內和體外,外泌體具有與抗原遞呈細胞相似的作用,可誘導和增強免疫反應。外泌體的大小和含量有很大的差異,其生物學效應和靶向性也不盡相同。因此,外泌體作為腫瘤進展、轉移、免疫調節、血管生成和組織再生等特異信號的重要載體而備受關注。
一、腫瘤微環境在促進HCC發生發展中的作用
數據顯示TME具有明確的原致癌基因作用,并在HCC發展和轉移中起促進作用。TME被認為是通過提供抑制或刺激信號來調節細胞系的生存生長。近年來,越來越多的證據證明外泌體是生理場景中特定信號的重要載體。此外,外泌體作為一種新的細胞間通訊媒介,在TME中作為腫瘤發生和進展的媒介,也得到了越來越多的研究。
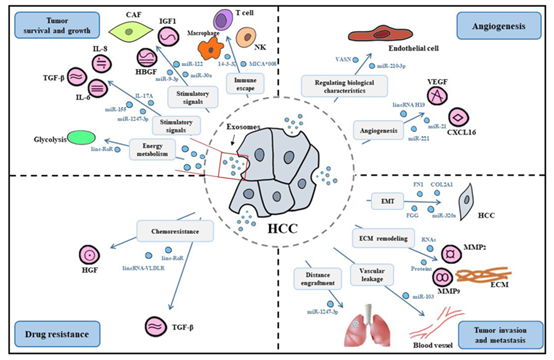
Fig. 1 TME中的外泌體在促進HCC發生發展過程中的作用。外泌體介導的免疫調控參與了TME的調節,具有免疫抑制和致耐受的特性。HCC涉及多個過程,包括腫瘤存活、生長、血管生成、侵襲和轉移。肝癌TME形成的具體機制包括能量代謝調控、刺激信號供應和抑制信號規避。此外,外泌體通過改變內皮細胞的生物學特性誘導血管生成,并直接調控促血管新生因子和促滲透因子。此外,外泌體可能通過EMT、ECM降解和血管滲漏引導HCC轉移侵襲。最后,外泌體與耐藥性之間的關系表明,在TME中存在復雜的耐藥機制。
二、肝癌微環境中外泌體介導的免疫調節
1.HCC來源的外泌體可以調節免疫細胞的表型和功能,有利于腫瘤細胞逃避免疫破壞。反過來,TME中免疫細胞分泌的外泌體可以影響抗腫瘤免疫反應。
例如:丙型肝炎病毒E2包膜糖蛋白(HCV-E2)可刺激肥大細胞分泌大量富含miR-490的外泌體。這些外泌體被轉移到HCC細胞中,通過抑制ERK1/2通路抑制腫瘤細胞的新陳代謝。
2.來自腫瘤相關巨噬細胞(TAMs)的外泌體在免疫抑制、血管生成和腫瘤進展中發揮著關鍵作用。
例如:人類巨噬細胞可以將含有miR-142和miR-223的外泌體轉移到肝細胞,抑制腫瘤細胞的增殖或生長。
綜上所述,HCC具有采用不同策略逃避宿主免疫監測的能力,外泌體是通過免疫調節交替傳播腫瘤進展的重要促進因子。
三、外泌體為HCC的發展和進展構造了腫瘤微環境
1. 腫瘤的存活和生長:基于外泌體的通訊在肝癌細胞微環境中是一個決定因素
腫瘤的發生和發展依賴于其復雜的、異質性的微環境,這一過程受到外泌體介導的TME內轉移的影響。
(1)調節能量代謝
腫瘤細胞產生的缺氧誘導因子(HIF)是腫瘤代謝的重要調節因子。使腫瘤細胞可以在低氧條件下重新編程能量代謝,實現惡性增殖。HCC來源的外泌體可以激活microRNA-145/HIF-1α/PDK1通路,可以增強糖酵解過程和抵制缺氧的環境。
(2)提供刺激信號
HCC分泌的外泌體調節周圍微環境,創造有利于腫瘤生長發育的條件;調節炎癥微環境以促進癌癥進展和轉移。
例如,當暴露于亞砷酸鹽中時,HCC細胞產生mir -155豐富的外泌體,這些外泌體增強炎癥反應,并與IL-6或IL-8水平呈正相關。
從周圍非腫瘤細胞分泌的外泌體可以傳遞生長信號,促進腫瘤的擴張和侵襲性。
例如:當肝損傷發生時,肝外泌體通過增加IL-17A的產生來激活肝星狀細胞(HSCs)。
(3)逃避抑制性信號
外泌體來源的miRNA可以介導HCC與TME之間的生物學信息傳遞,并以多種形式參與HCC的生物學過程。外泌體介導的HCC在逃避抑制信號從而促進癌細胞惡性行為方面存在潛在的影響。
例如:miR-30a作為一種腫瘤抑制因子,已被證明可以抑制肝癌的遷移和侵襲。HCC通過下調組織和細胞系中的miR-30a,促進血管浸潤、轉移潛能和復發性疾病。
2. 外泌體誘導的血管生成:腫瘤微環境具有復雜的影響
活躍的血管生成被認為是腫瘤快速生長、早期轉移和生存不良的主要原因。此外,外泌體通過蛋白、核酸等物質調控細胞間通訊,改變TME,誘導血管腔的形成,最終促進腫瘤細胞的惡性增殖和侵襲性表型。
(1)調節內皮細胞(ECs)的生物學特性
ECs被認為是TME的重要組成部分,在腫瘤發展過程中為營養物質、氧氣和各種生長因子提供通道。腫瘤細胞來源的含有功能蛋白和miRNA的外泌體可以影響內皮細胞的生物學命運。
(2)促進腫瘤血管生成
除了EC小管生成相關的血管生成外,外泌體還參與了促進腫瘤血管生成的其他機制。外泌體可以調控靶細胞相關基因的轉錄,促進血管生成。外泌體還參與調控HCC血管生成相關信號通路。
3. 外泌體介導的HCC侵襲和轉移:局部和遠端的微環境是關鍵的避難所
轉移是區分腫瘤與非腫瘤性疾病的一個重要特征。在遠端轉移發生前,腫瘤分泌的外泌體可激活侵襲性相關可溶性因子,重塑局部和遠端TME,實現腫瘤轉移侵襲。
(1)外泌體和上皮-間質轉移(EMT)
上皮間質轉化(epithelial -mesenchymal transformation, EMT)是一種可逆的去分化過程,其特征是上皮特征的喪失和典型間質特征的獲得,被認為是HCC侵襲轉移的中心機制。HCC細胞來源的外泌體可提高細胞培養上清液中的HGF水平。在TME中,HGF被認為通過EMT、遷移和侵襲引起HCC表型改變。最近的一項研究從相反的角度證實了HCC衍生的外泌體和EMT的誘導之間可能存在相關性。
(2)外泌體介導的ECM重構促進局部腫瘤侵襲
ECM的主要成分包括膠原蛋白、椎板蛋白、纖連蛋白、糖胺聚糖和蛋白聚糖,它們在改變HCC和間質細胞的表型和功能特征方面發揮著非常重要的作用。外泌體可以通過增強ECM的重組而建立機械僵硬的微環境,最終促進腫瘤的轉移。HCC衍生的外泌體觸發基質金屬蛋白酶(MMPs)的產生,并使ECM降解激活局部侵襲和細胞遷移
(3)外泌體促進血管滲漏,有利于腫瘤細胞的移植
腫瘤來源的外泌體與其血管通透性的轉化有關,最終導致腫瘤的轉移擴散。
例如:內皮細胞之間的細胞間連接依賴VE-cadherin,連環蛋白(p120、p0071和β-catenin), ZO-1, claudin-5。肝癌細胞來源的miR-103可通過外泌體傳遞到內皮細胞,抑制VE-cadherin、p120- catenin (p120)和ZO-1的表達,減弱內皮細胞連接的完整性,誘導血管滲漏,從而促進腫瘤轉移。
四、外泌體在HCC微環境中的治療作用
肝癌微環境中基于外泌體的通信在可以作為決定因素促進癌細胞的惡性發展,肝癌微環境中的外泌體在可能為靶向治療提供一個機會,最終防止肝癌繼續發展和延長肝癌患者的生存時間。由于外泌體介導的TME免疫調節在HCC的發生發展過程中發揮著重要作用,因此我們有理由認為,基于外泌體的通訊系統有助于刺激免疫應答,介導HCC免疫治療。此外,人們對外泌體作為藥物和生物分子轉移治療工具的應用越來越感興趣。
1.肝癌微環境中基于外泌體的免疫治療
增強免疫是肝癌治療的基本方法。外泌體具有增強腫瘤免疫原性和抗腫瘤免疫反應的作用。
例如:腫瘤細胞來源的外泌體表達一系列HCC抗原,在臨床前模型中顯著激活樹突狀細胞(DCs)介導的免疫應答,最終重塑HCC免疫微環境,提高抗腫瘤效果。DC來源的外泌體已被證明是可以作為癌癥疫苗的有效免疫治療手段。
2.外泌體作為HCC微環境中的治療工具
外泌體具有良好的生物相容性和穩定性、耐修飾性以及跨越血腦屏障等優點,有望成為治療癌癥的藥物和生物分子傳遞載體。在化療給藥的一個例子中,外泌體被用作靶向藥物給藥載體,具有較低的免疫原性和毒性。
3. 肝癌微環境中化學敏感性與外泌體的關系
HCC已被證明對傳統的化療策略具有耐藥性,而外泌體與耐藥性之間的關系為HCC化療耐藥的新策略提供了重要的見解。
例如:外泌體通過促進CD133+ T-IC和ABCG2在TME中的表達,參與了促進化療耐藥的作用;HCC細胞來源的外泌體可觸發HGF/c-Met/Akt信號通路,在抑制索拉非尼誘導的細胞凋亡和促進肝癌耐藥方面發揮重要作用。
結論:
TME是惡性細胞生存、生長、增殖和轉移所需的細胞環境。外泌體作為新型的TME細胞間溝通介質,在促進腫瘤發生發展方面受到了廣泛關注。文章綜述了外泌體在肝細胞癌發生發展過程中建立和修飾TME的作用;揭示了HCC微環境中基于外泌體通訊促進癌細胞惡性行為的具體機制。外泌體介導的對肝癌患者的治療可能涉及外泌體在TME中的多方面作用。未來的研究需要闡明外泌體在TME中具有效應功能的潛在機制為基于外泌體通訊系統的靶向治療干預提供了機會。






