室下區神經干細胞釋放細胞外囊泡作為小膠質細胞形態原
室下區(SVZ)神經干細胞(NSCs)是圍產期神經小生境的基礎。小膠質細胞是神經系統的免疫細胞,在新生兒SVZ中富集。雖然小膠質細胞調節NSCs,但這種相互作用的雙向程度尚不清楚。2018年4月,在Cell Report (IF=8.032)上發表的一篇名為“Neonatal Subventricular Zone Neural Stem Cells Release Extracellular Vesicles that Act as a Microglial Morphogen”就講述了神經干細胞分泌的外泌體誘導小膠質細胞變形的故事。SVZ NSCs生成和釋放EV,胞外囊泡(EVs)是包裹miRNA和蛋白的細胞源性顆粒。熒光標記的EV融合蛋白由NSCs釋放,隨后從SVZ中清除。EV優先針對微神經膠質。小RNA測序鑒定了EVs中調節小膠質細胞生理和形態的miRNA。EVs誘導細胞向CD11b/ Iba1非星狀小膠質細胞形態轉變。轉錄時伴有小膠質細胞轉錄狀態,其特征是let -7調控的細胞因子釋放和控制NSC增殖的負反饋環。這些發現暗示了NSC細胞-EV-小膠質細胞軸的存在。
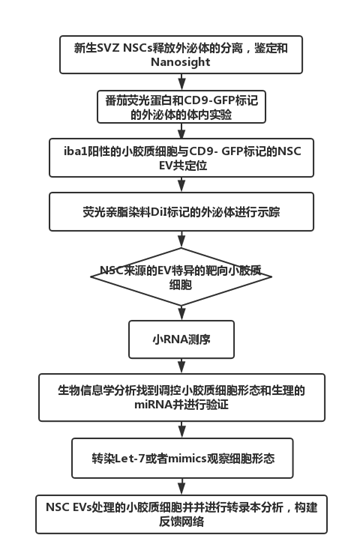
技術路線
結果
1、新生SVZ NSCs釋放Evs分離與鑒定
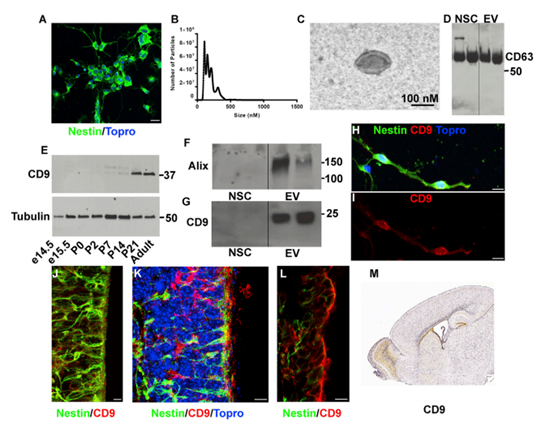
原代SVZ NSCs培養為單層培養,從產后0 (P0)小鼠開始,對NSC標記蛋白Nestin進行免疫細胞化學實驗。新生兒SVZ培養物為DCX陰性,而大多數細胞為巢蛋白陽性(92%)(圖1A)。對新生的SVZ NSC培養基進行低速離心,,然后進行納米顆粒跟蹤分析。 (圖1 B)。NSC EV大小經電鏡證實為外泌體形態(圖1C)。CD63是EV標記蛋白,證實在NSCs和EV中表達(圖1D)。另一種EV蛋白CD9在背前腦提取物中被檢測到。新生兒大腦中存在CD9, P7上調(圖- 1E)。western blot檢測原發性新生兒SVZ NSC EVs中CD9(圖1F)。此外,SVZ NSC EV中還存在外泌體貨運蛋白ALIX(圖1G)。CD9表達在原發性SVZ NSC培養基中通過免疫細胞化學進一步證實(圖1H和1I)。為了檢測體內CD9蛋白的表達,作者對P0和P4大腦進行了免疫組化。P4時,在巢蛋白陽性的NSCs中,CD9表達沿著心室壁傳輸(圖1J-1L)。在新生兒SVZ中CD9的富集與Allen腦研究所矢狀切片原位雜交相一致(圖1M)。這些結果都證實了新生兒SVZ神經干細胞釋放胞外囊泡的存在。
2. 體內實驗證明SVZ NSCs釋放CD9
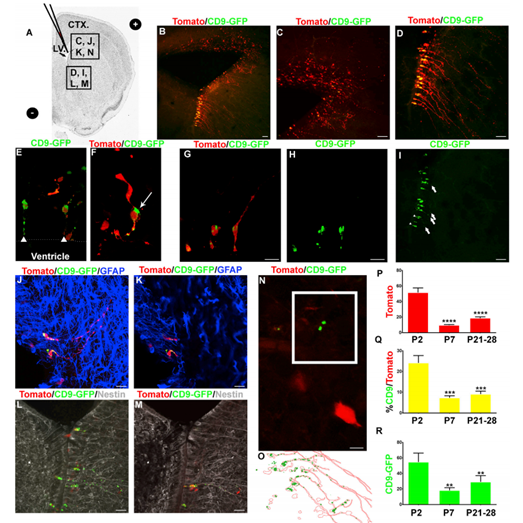
為了研究NSC外泌體,將番茄熒光蛋白和CD9-GFP編碼質粒電轉至P0小鼠SVZ,并檢測NSCs(圖2A)。在整個體細胞中檢測到番茄熒光蛋白的表達(圖2B-2D)。CD9-GFP陽性細胞在腹外側心室壁最常見(圖2B - 2D)。CD9-GFP在具有b1樣NSC形態的細胞中被檢測到(圖2E-2H)。CD9-GFP定位于頂端和基質的過程(圖2E和2I)。P7對膠質原纖維酸蛋白(GFAP)的NSC形態學染色呈陽性(圖2J和2K)。b1樣的番茄/CD9-GFP-陽性細胞也呈巢蛋白陽性,證實其為NSCs(圖2L和2M)。在電穿孔細胞外檢測到CD9-GFP(圖2N和2O)。檢測到52個番茄陽性細胞/SVZ 48小時后電循環(圖2P)。SVZ中殘存的番茄陽性細胞較P2-P7明顯減少80%(圖2P)。,在P7時,共表達CD9-GFP和番茄的細胞百分比從24%顯著降低到7.32%(圖2Q)。在P21-P28的大腦中,CD9-GFP/番茄共表達細胞百分比的降低是相似的。考慮到番茄陽性細胞的減少,與番茄/CD9-GFP雙陽性細胞一致,這些結果支持了71%的CD9-GFP/番茄陽性細胞為NSCs的模型。每個電穿孔細胞電孔48小時后,至少可檢測到一個細胞外顆粒(54.77 CD9-GFP顆粒/圖像)(圖2R)。在P21-P28小鼠中,共電穿孔番茄NSCs外的CD9- GFP顆粒數在電穿孔后7天內下降至18.20個顆粒,且保持相似(19.06)(圖2R)。這些結果表明SVZ NSCs釋放CD9, CD9可以從細胞外環境中次序的被清除。
3.SVZ神經干細胞胞外囊泡EV是針對小膠質細胞的
iba1陽性的小膠質細胞與來自新生SVZ NSC細胞外CD9- GFP共定位(圖3A和3B)。作為一項初步實驗,為了進行更公正的評估,將轉染CD9- GFP N2a細胞的外泌體用熒光親脂染料DiI標記。然后將外泌體注射入新生兒小鼠的側腦室(圖3C)。注射后一到七天,老鼠被收集,大腦被分離。側腦室附近的細胞群用DiI和GFP標記(圖3D-3E)。細胞偶有星狀形態,類似于小膠質細胞(圖3F)。Iba1染色證實這些細胞是小膠質細胞(圖3F)。用DiI標記P100組分的SVZ NSC EVs,并將其注射到P0小鼠體內。NSC EVs主要針對iba1陽性的小膠質細胞(圖3H)。EV標記的小神經膠質常呈圓形,常與側腦室和SVZ相鄰。CD68和CD11b是新生SVZ小膠質細胞外壓的兩個小膠質細胞標記物。與這些發現一致的是,dii標記的細胞對CD68和Iba1以及CD11b和Iba1呈雙重陽性(圖3I-3K)。
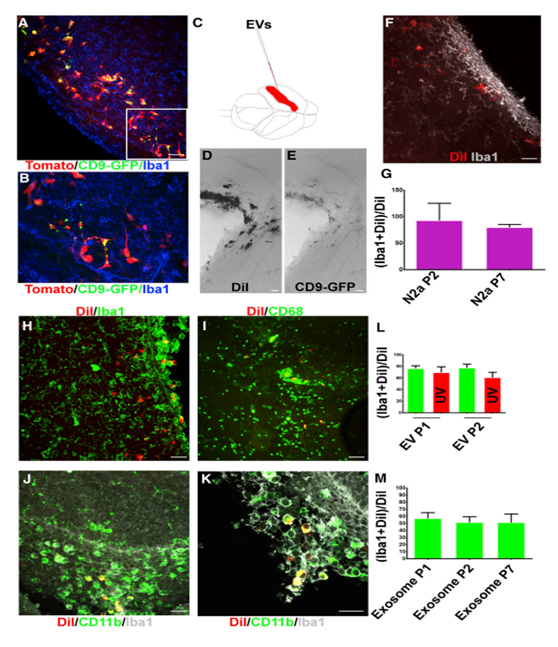
4.神經干細胞胞外囊泡和RNA含量調節小膠質細胞形態
為了確定EVs對小膠質細胞的功能影響,進行了小RNA測序。在NSC P100 EV中發現了大量的miRNA,大于平均miRNA的10倍(圖4A)。miR-9、Let-7、miR-26和miR-181在NSC EV中高度富集。都在調節小膠質細胞形態和生理方面發揮作用.假設EVs調控cd11b陽性的小膠質細胞以誘導圓形非星狀表型(圖4B)。與對側半球相比,NSC P100 EV移植增加了cd11b陽性小膠質細胞(圖4C和4D)。與對照組相比,UV預處理EVs導致cd11b陽性的小膠質細胞減少(圖4E)。作者推測外源體Let-7可能調控小膠質細胞的形態。收集轉染Let-7的N2a細胞外泌體。體外酶體經過模擬或合成Let-7轉染,移植到新生小鼠SVZ中。經合成的Let-7 miRNA轉染的外泌體誘導小膠質細胞獲得了一種與MIMICS轉染外泌體不同的圓形外觀(圖4I-4L)。這些結果證實SVZ NSCs釋放的外泌體是針對小膠質細胞的、被小膠質細胞吸收和修飾的。
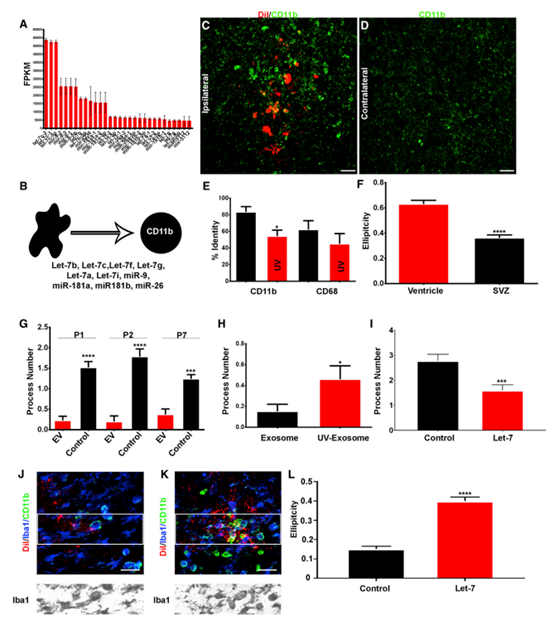
5. NSC EVs激活小膠質細胞轉錄網絡,形成NSC反饋回路
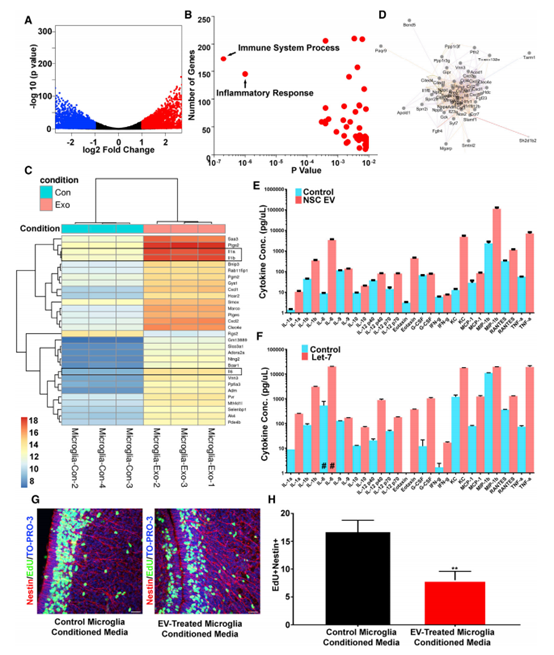
NSC EVs激活小膠質細胞轉錄網絡, NSC EVs處理的小膠質細胞有1713個轉錄本上調大于2倍(圖5A)。GO分析表明,免疫系統過程和炎癥反應是最豐富和最顯著的表達(圖5B)。熱圖中轉錄本的檢測顯示,上調程度最高的轉錄本包括白細胞介素-1a (IL-1a)、IL-1b和IL-6等細胞因子(圖5C)。與此一致的是,對頂端差異調節轉錄本的網絡分析包括了該網絡核心的一個細胞因子節點(圖5D)。細胞因子的上調在小膠質條件培養基中得到驗證(圖5E)。合成的含有let -7的EV可以刺激模擬NSC EVs作用的小膠質細胞因子的強力釋放(圖5F)。為了驗證小膠質細胞攝取NSC外泌體的功能意義,將未處理或EV處理的小膠質細胞的條件培養基注射回P0小鼠側腦室,并進行EdU標記(圖5G)。由外泌體處理的小膠質細胞產生的條件培養基,但不能控制小膠質細胞,減少了分裂NSCs的數量(圖5H)。綜上所述,這些結果表明外泌體對新生兒時期小膠質細胞信號通路的影響是顯著的。