由miR-18a-5p靶向的SREBP1通過與Snail和HDAC1/2形成共抑制因子復合物調節乳腺癌中的上皮-間質轉化
局部乳腺癌遠端轉移的進展導致預后不良和高死亡率。近日,發表在《Cell Death and Differentiation》上的一篇名為《SREBP1, targeted by miR-18a-5p, modulates epithelial-mesenchymal transition in breast cancer via forming a co-repressor complex with Snail and HDAC1/2》的文章探討了miRNA對腫瘤進展的貢獻以及導致其表達改變的調節機制。使用來自親代乳腺癌細胞的高度肺轉移亞系,miRNA表達譜顯示miR-17-92簇顯著下調,miR-18a-5p是下調最明顯的。異位表達和miR-18a-5p的抑制證明了其抑制乳腺癌細胞遷移和侵襲的能力。進一步研究發現控制脂質代謝的主要轉錄因子固醇調節元件結合轉錄蛋白1(SREBP1)是miR-18a-5p的候選靶標。SREBP1過度表達并且與乳腺癌的較差臨床效果密切相關。功能上SREBP1在體外和體內促進乳腺癌的生長和轉移。為了揭示SREBP1介導的轉移的潛在機制,進行了mRNA分析和隨后的基因集富集分析(GSEA),并證明SREBP1與上皮-間質轉化(EMT)顯著相關。此外,發現SREBP1介導的E-鈣黏蛋白抑制依賴于脫乙酰化,并且通過募集Snail/HDAC1/2阻遏復合物而增強。根據這些數據,認為miR-18a-5p的表達降低和伴隨的SREBP1過表達導致EMT狀態的誘導,進而促進乳腺癌進展和轉移。總之,該項研究揭示了miR-18a-5p和SREBP1在EMT和轉移中的關鍵作用,從而為晚期乳腺癌的針對性治療提供了有希望的藥物靶標。
技術路線

結果
1.MiR-18a-5p被鑒定為抑制乳腺癌侵襲性的候選miRNA
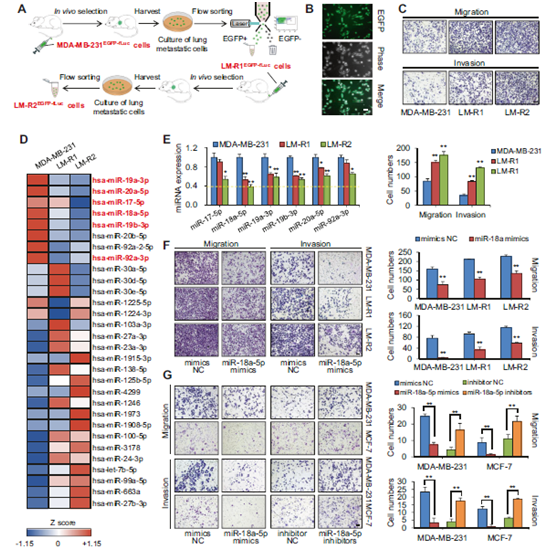
圖1高度肺轉移性乳腺癌細胞的體內選擇將miR-18a-5p鑒定為抑制乳腺癌侵襲的候選miRNA。
a 高度肺轉移性乳腺癌細胞的體內選擇程序流程圖。將親本MDA-MB-231EGFP-Fluc從尾靜脈注射到Balb/c雌性小鼠中以形成肺轉移。八周后,收獲第一輪亞系LM-R1EGFP-fLUC,培養,通過流式細胞術分選并再接種到小鼠中以獲得第二輪亞系LM-R2EGFP-fLUC。b LM-R1EGFP-fLUC的典型熒光和相位對比圖像。比例尺:20 μm。c Transwell實驗顯示MDA-MB-231EGFP-Fluc的遷移和侵襲能力在體內選擇期間連續增加(LM-R2EGFP-fLUC> LM-R1EGFP-fLUC> MDA-MB-231EGFP-Fluc)。侵入細胞的典型區域用結晶紫染色(n = 3)。比例尺:20 μm。d MDA-MB-231EGFP-fLUC,LM-R1EGFP-fLUC和LM-R2EGFP-fLUC的差異miRNA譜的表達熱圖。e 通過qPCR檢測的miR-17-92簇中六個成員的表達與微陣列中一致(n = 3)。f Transwell實驗顯示miR-18a-5p損害MDA-MB-231 EGFP-fLUC,LM-R1EGFP-fLUC和LM-R2EGFP-fLUC的遷移和侵襲能力(n = 3)。左,被侵襲細胞結晶紫染色的典型區域;右,三個隨機區域被侵襲細胞的相對定量。比例尺:20μm。g Transwell實驗表明miR-18a-5p模擬物損害了MDA-MB-231和MCF-7的遷移和侵襲能力,而miR-18a-5p抑制劑提高了轉移效果(n = 3)。比例尺:20μm。* P <0.05,** P <0.01。
2.MiR-18a-5p通過直接靶向SREBP1抑制遷移和侵襲
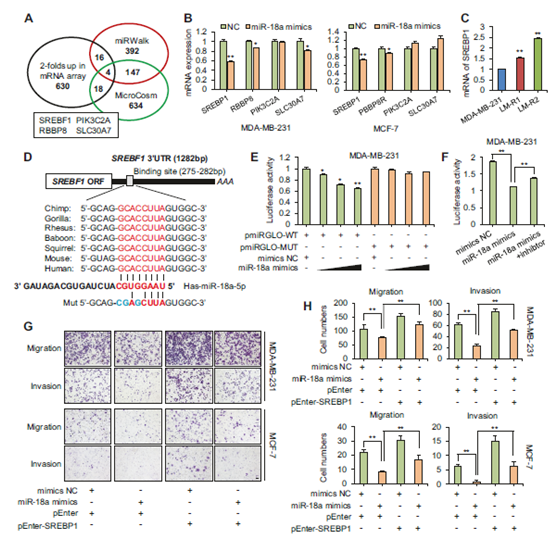
圖2 MiR-18a-5p靶向SREBP1抑制遷移和侵襲。
a 維恩圖表示通過mRNA微陣列、miRWalk和MicroCosm鑒定的miR-18a-5p的共有候選靶基因。b miR-18a-5p模擬物處理后,通過qPCR檢測,四種候選靶標(SREBP1,PIK3C2A,RBBP8和SLC30A7)中SREBP1的表達最明顯地被抑制(n = 3)。c MDA-MB-231,LM-R1和LM-R2中SREBP1的mRNA表達(n = 3)。d 8種生物體的miR-18a-5p在SREBP1的3'UTR上預測結合位點的比對。突變體中相應序列的結構。Mut:突變體。e用0到100nM濃度梯度的miR-18a-5p模擬物共轉染SREBP1野生型或突變型3'UTR后,MDA-MB-231細胞的熒光素酶報告基因檢測(n = 3)。WT:野生型,MUT:突變型。f 用miR-18a模擬物±抑制劑共轉染SREBP1野生型3'UTR后,MDA-MB-231細胞的熒光素酶報告基因檢測(n = 3)。g Transwell實驗顯示,瞬時轉染法SREBP1的恢復可部分消除miR-18a-5誘導的MDA-MB-231和MCF-7中遷移和侵襲的抑制。比例尺:20μm。h 對上述細胞的遷移和侵襲進行定量分析(n = 3)。* P <0.05,** P <0.01。
3. SREBP1表達上調并與乳腺癌的存活相關

圖3 乳腺癌中SREBP1表達上調,顯示總體存活率較低。
a 在乳腺正常組織和癌組織中SREBP1表達的免疫組化染色的典型圖像。IDC Ⅱ:侵襲性導管癌Ⅱ級,IDC Ⅲ:侵襲性導管癌Ⅲ級。b 乳腺腫瘤組織和對應正常組織中SREBP1c mRNA表達的qPCR(n = 30對)。c 組織微陣列中329個人乳腺癌組織中SREBP1的細胞核和細胞質染色強度的典型免疫組化圖像。d從細胞核,細胞質和總SREBP1方面,對SREBP1表達高或低的患者的整體存活和特異存活進行Kaplan-Meier生存分析。
4.SREBP1在體外和體內促進細胞生長和侵襲
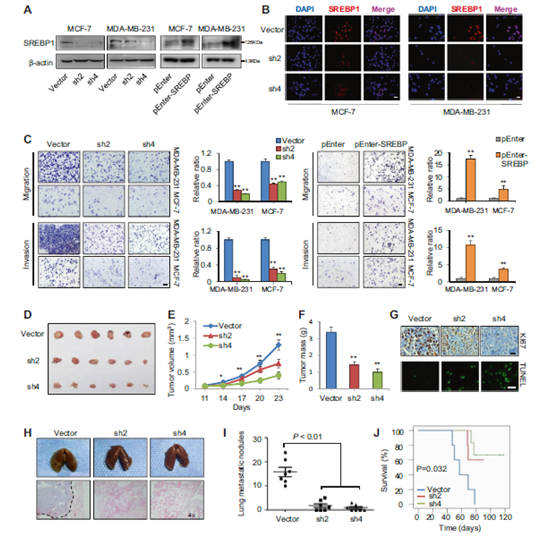
圖4 SREBP1在體外和體內促進細胞生長和侵襲。
a 通過WB驗證穩定敲低(左)和過表達(右)MDA-MB-231和MCF-7細胞系的效率。b 免疫熒光分析顯示,在MDA-MB-231和MCF-7細胞系中,shRNA沉默減少了細胞核中的SREBP1活性形式。DAPI用于指示核位置。比例尺:20μm。c 用SREBP1敲低或過表達載體(n = 3)穩定轉染后,MDA-MB-231和MCF-7細胞的Transwell遷移和侵襲實驗。展示了被侵襲細胞結晶紫染色的典型區域,并對三個隨機區域的被侵襲細胞進行了定量分析。比例尺:20μm。d 植入MDAMB-231對照細胞或穩定的SREBP1敲低細胞(1×107)的裸鼠中異種移植腫瘤的圖像(n = 6)。e 裸鼠中SREBP1敲低和對照MDA-MB-231細胞的腫瘤生長曲線(n = 6)。f 在實驗完成時稱量植入對照和穩定的SREBP1敲低細胞的裸鼠的腫瘤重量(n = 3)。g 典型異種移植腫瘤的Ki67和TUNEL染色。比例尺:20μm。h SREBP1敲低后肺轉移減少(n = 7)。上:注射SREBP1敲低或對照MDA-MB-231細胞后小鼠的全肺圖像;下:肺轉移性腫瘤的典型蘇木精和伊紅染色圖。i 原位注射SREBP1敲低或對照MDA-MB-231細胞(n = 7)后肺表面的轉移結的定量。j 注射SREBP1敲低或對照MDA-MB-231細胞的小鼠的存活率(n = 6)。* P <0.05,** P <0.01。
5.SREBP1通過誘導EMT促進細胞轉移
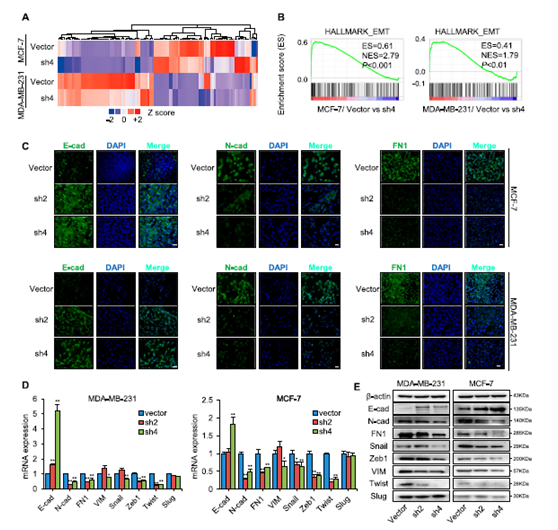
圖5 SREBP1通過誘導EMT促進細胞轉移。
a 在穩定的SREBP1敲低和對照乳腺細胞中基于微陣列的差異基因表達轉錄分析。b 基因集富集分析顯示富含SREBP1的細胞與MDA-MB-231和MCF-7細胞中的EMT基因列表顯著相關。c 用對照載體或shSREBP1載體轉染的MDA-MB-231和MCF-7細胞中E-鈣黏蛋白、N-鈣黏蛋白和纖連蛋白表達的免疫熒光分析。DAPI用于指示核位置。比例尺:20μm。d 用對照載體和shSREBP載體轉染的MDA-MB-231和MCF-7細胞中EMT相關標志物的mRNA水平(n = 3)。e SREBP1敲低后的MDA-MB-231和MCF-7細胞中EMT相關標志物的WB結果。* P <0.05,** P <0.01。
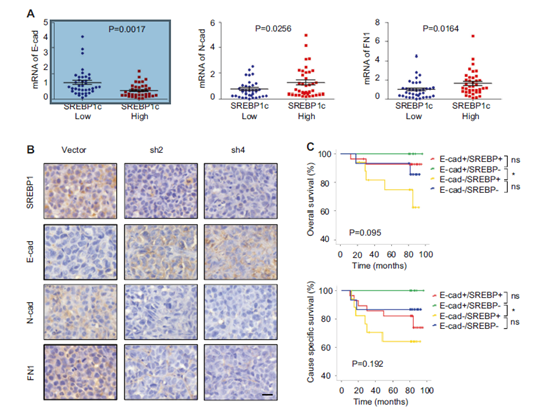
圖6 臨床樣本中SREBP1表達與EMT標記顯著相關。
a 通過qPCR方法研究SREBP1表達與EMT相關標志物(E-鈣黏蛋白,N-鈣黏蛋白和纖連蛋白)之間的相關性(n = 3)。根據表達水平中值對SREBP1進行分層定義“高”和“低”表達水平。b 通過免疫組化染色檢測對照和shSREBP1異種移植腫瘤中SREBP1,E-鈣黏蛋白,N-鈣黏蛋白和纖連蛋白的表達。比例尺:20μm。c 總體存活和特異性存活的Kaplan-Meier生存分析表明,SREBP1 mRNA與E-鈣黏蛋白mRNA結合可預測乳腺癌患者存活結果。* P <0.05,** P <0.01。
6.SREBP1通過與HDAC1/2和Snail形成共抑制因子復合物來調節EMT以抑制E-鈣黏蛋白
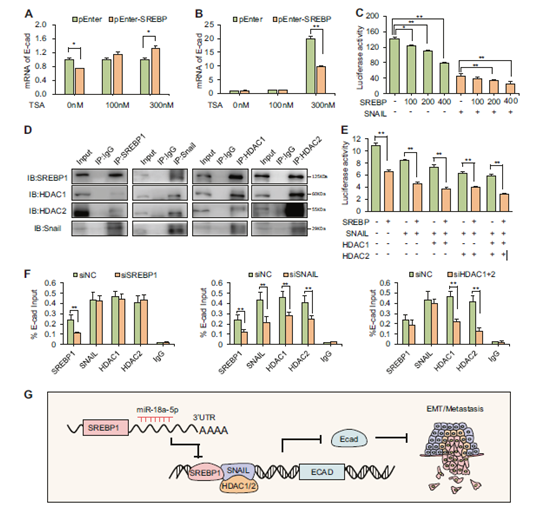
圖7 SREBP1通過與HDAC1/2和Snail形成共抑制因子復合物抑制E-鈣黏蛋白來調節EMT。
a 當用SREBP1過表達載體轉染MDA-MB-231 48小時再用0 nM、100 nM和300nM TSA處理后,通過qPCR檢測E-鈣黏蛋白表達的mRNA表達(n = 3)。b 先用0 nM、100 nM和300nM TSA處理MDA-MB-231 48小時再用SREBP1過表達載體轉染后,用qPCR檢測E-鈣黏蛋白表達的mRNA表達(n = 3)。c 通過熒光素酶報告基因檢測確定Snail存在或不存在的情況下SREBP1對E-鈣黏蛋白啟動子的轉錄抑制作用(n = 3)。d 通過co-IP檢測觀察到SREBP1與Snail和HDAC1/2的物理相互作用。e 熒光素酶報告基因檢測驗證Snail/HDAC1/2促進SREBP1對E-鈣黏蛋白表達的抑制作用(n = 3)。f ChIP-qPCR檢測證實SREBP1/Snail/HDAC1/2向E-鈣黏蛋白啟動子募集。SREBP1沉默不影響Snail,HDAC1和HDAC2向E-鈣黏蛋白啟動子募集(左),而Snail的沉默顯著解離了E-鈣黏蛋白啟動子的Snail,SREBP1和HDAC1/2(中)。HDAC1和HDAC2的同時敲低不會妨礙Snail以及SREBP1向啟動子區域的募集(右)。g miR-18a-5p靶向SREBP1抑制SNAIL/HDAC1/2誘導的EMT和乳腺癌轉移機制示意圖。* P <0.05,** P <0.01。






